COVID: EE.UU. espera aplicar 600,000 dosis del anticuerpo monoclonal de Eli Lilly, efectivo contra Ómicron y la subvariante BA.2
Tanto el Gobierno de EE
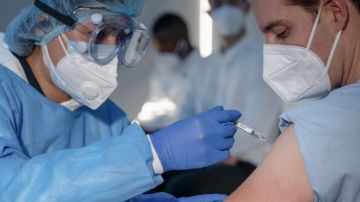
La compañía Eli Lilly aclaró que su anticuerpo monoclonal es un tratamiento para el COVID-19 de leve a moderado en ciertos pacientes de alto riesgo. Crédito: Shutterstock
El secretario del Departamento de Salud y Servicios Humanos de Estados Unidos (HHS), Xavier Becerra, informó que el gobierno federal adquirió 600,000 dosis del nuevo anticuerpo monoclonal contra el COVID-19, desarrollado por el gigante farmacéutico Eli Lilly. Según datos de la compañía, el tratamiento es efectivo contra la variante Ómicron y la subvariante BA.2.
La administración del presidente Biden espera poder aplicar estas 600,000 dosis a los pacientes que lo ameriten, en respuesta a las reducidas opciones de tratamiento que ha dejado la oleada de Ómicron.
Aunque la Administración de Alimentos y Medicamentos (FDA) del país aún no ha autorizado el uso de emergencia de este anticuerpo monoclonal, el gobierno federal y el HHS confían en que la aprobación llegue muy pronto. “Vamos a tratar de satisfacer la demanda”, dijo el secretario de Salud, Xavier Becerra.
El pasado lunes 24 de enero, la FDA decidió “limitar” el uso de tratamientos de anticuerpos contra el COVID-19, ya que “es muy poco probable” que sean efectivos contra la variante Ómicron, mucho más infecciosa que cepas anteriores.
Aunque prácticamente los eliminó, la FDA empleó la palabra “limitar” porque ambos dichos tratamientos sí podrán ser utilizados “cuando el paciente haya sido infectado o expuesto a una variante que sea susceptible a estos tratamientos”, es decir, no Ómicron.
Eli Lilly afirmó que su anticuerpo monoclonal es efectivo contra Ómicron y la subvariante BA.2
El gigante farmacéutico indicó en su sitio web que ya planteó la solicitud de autorización a la FDA para el uso de emergencia de su anticuerpo monoclonal “bebtelovimab”, un tratamiento para el COVID-19 de leve a moderado en ciertos pacientes de alto riesgo.
“Las pruebas de pseudovirus y virus auténticos demuestran que ‘bebtelovimab’ retiene la actividad neutralizante total contra Omicron, actualmente la variante predominante en el mundo”, informó Eli Lilly en el comunicado oficial.
“Además, las pruebas de pseudovirus con ‘bebtelovimab’ demuestran que conserva la neutralización frente a todas las demás variantes conocidas de interés y preocupación, incluido BA.2″, destacó la compañía.
El acuerdo entre Eli Lilly y el gobierno de Estados Unidos prevé la entrega de 600,000 dosis del tratamiento, a más tardar el 31 de marzo. Además, hay una opción abierta para la entrega de 500,000 dosis adicionales, en julio.
El anticuerpo monoclonal ‘bebtelovimab’ es de administración por vía endovenosa y solo debe aplicarse en las primeras fases de una infección por COVID-19, con el objetivo de prevenir complicaciones en la salud del paciente, lo que incluye hospitalización y muerte.
Según destacó la compañía Eli Lilly, “más de 700,000 pacientes han sido tratados con nuestros anticuerpos monoclonales, previniendo potencialmente más de 35,000 hospitalizaciones y al menos 14,000 muertes durante lo peor de la pandemia”.
Te puede interesar:
· COVID: hallan el anticuerpo monoclonal capaz de neutralizar todas las variantes

















